nach: Taschenatlas der Physiologie, Silbernagel u. Despopoulos
Das Blut – Zusammensetzung und Eigenschaften
Fließeigenschaften des Blutes
Erythrozyten sind sehr leicht verforrnbare, kernlose „Zellen“. Die niedrige Viskosität ihres Inhalts, die flüssigkeitsfilmähnlichen Eigenschaften ihrer Membran und ihr hohes Oberflächen/Volumen-Verhältnis bewirken, dass sich das Blut, besonders wenn es schnell fließt, weniger wie eine Zellsuspension als vielmehr wie eine Emulsion verhält. Die Viskosität des fließenden Blutes ist mit ca. 4 relativen Einheiten (r. E.) daher nur etwa doppelt so hoch als die des Plasmas (2 r. E.; bei 37°C).
Die Passage feiner Blutkapillaren und die der Poren in der Milzstrombahn, deren Weite viel geringer ist als der Durchmesser frei schwimmender Erythrozyten, sind für normale Erythrozyten wegen ihrer guten Verformbarkeit kein Problem. Die langsame Strömung in kleinen Gefäßen erhöht dort allerdings die Viskosität, was z. T. dadurch kompensiert wird, dass die Erythrozyten zentral im Blutstrom schwimmen. Die Viskosität des Blutes kann aber kritisch ansteigen, wenn a) sich die Strömung zu sehr verlangsamt und/oder b) sich die Fluidität der Erythrozyten durch Hyperosmolalität („Stechapfelforrn“ der Erythrozyten), durch ZeIleinschlüsse, durch Hämoglobinfehlbildungen (z. B. bei Sichelzellanämie), durch Veränderungen der Zellmembran (z.B. bei „alten“ Erythrozyten) u.a.m. erniedrigt. Unter solchen Umständen erhält das Blut durch Aggregation („Geldrollenbildung“) der Erythrozyten Eigenschaften einer Suspension mit hoher Viskosität (bis 1000 r. E.), was in kleinen Gefäßen schnell zum Stillstand der Blutströmung führen kann.
Plasmabestandteile
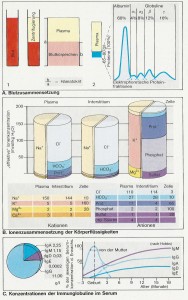
Plasma erhält man, wenn aus ungerinnbar gemachtem Blut die zellulären Elemente abzentrifugiert werden. Plasma besteht aus Wasser, in dem hochmolekulare Proteine (Abb. A) sowie ungeladene Stoffe (Glukose, Harnstoff u. a.) und Ionen mit niedrigem Molekulargewicht gelöst sind. All diese gelösten Teilchen addieren sich zur osmolalen Konzentration (Osmolalität) des Plasmas. Hauptanteile an dieser Osmolalität bilden bei den positiv geladenen Ionen (Kationen) das Na+, bei den negativ geladenen Ionen (Anionen) CI– und HCO3–.Die Proteine tragen viele anionische Netto-Ladungen, die alle elektrisch wirksam sind (Abb. B). Die osmotische Wirksamkeit der Proteine ist jedoch vergleichsweise geringer, weil dafür die Teilchen- und nicht die Ladungszahl bestimmend ist.
Proteine können nur in sehr geringem Umfang das Blutbett verlassen. Das Ausmaß schwankt je nach Organ. Die Kapillaren der Leber z.B. sind, relativ gesehen, viel durchlässiger als die des Gehirns. Die Zusammensetzung der interstitiellen Flüssigkeit unterscheidet sich daher, besonders was den Proteingehalt betrifft, mehr oder weniger von der des Plasmas (Abb. B). Grundsätzlich anders zusammengesetzt ist die Flüssigkeit im Zellinneren, wo K+ das vorherrschende Kation ist und Phosphate und Proteine den Hauptanteil der Anionen bilden (Abb. B). Diese Anteile wechseln von Zelltyp zu Zelltyp.
Die Plasmaproteine (Abb. A, rechts) bestehen zu etwa 60% aus Albumin (35-45 g/l), das für viele Substanzen, wie z. B. für Bilirubin oder für Hormone, Vehikelfunktion besitzt, die Hauptursache des kolloidosmotischen Druckes darstellt und bei Eiweißmangel als Proteinreserve dienen kann. Die a1-, a2– und ß-Globuline dienen u. a. dem Transport von Lipiden, Hämoglobin, Eisen, Kortisol und Kobalaminen. Auch die meisten Plasmafaktoren der Gerinnung und der Fibrinolyse sind Proteine.
Die Immunglobuline (Ig, Abb. C) gehören überwiegend zu den g-Globulinen. Sie sind die Abwehrproteine des Plasmas (Antikörper). IgG hat dabei die relativ höchste Plasmakonzentration (7-15 g/I) und kann die Plazentaschranke leichter als die anderen Immunglobuline passieren (Übertragung von Mutter zu Kind, Abb. C). Die Immunglobuline sind aus zwei jeweils gruppenspezifischen, schweren Proteinketten und aus zwei leichten Proteinketten aufgebaut, die miteinander in charakteristischer Y –Form über Disulfid-Brücken verknüpft sind.
Immunabwehr
Der Körper ist dauernd durch infektiöse Mikroben aus der Umwelt (Bakterien, Viren, Pilze, Parasiten) bedroht und besitzt daher Abwehrsysteme. die ihn dagegen weitgehend immun machen. Dabei sind eine (bezüglich des Erregers) unspezifische, angeborene Immunität und eine spezifische, erworbene (adaptive) Immunität (= Immunität im engeren Sinn) zu unterscheiden, doch sind beide Systeme eng miteinander verzahnt, und an beiden sind sowohl mobile Zellen als auch gelöste Faktoren beteiligt.
Dringen Erreger in den Körper ein, wird das unspezifische Abwehrsystem aktiv. Gleichzeitig stellen sie aber Antigene dar, auf die das spezifische Abwehrsystem mit der Produktion von Antikörpern reagiert, mit deren Hilfe der Organismus gewöhnlich sehr viel wirksamer mit den Erregern fertig wird und diese außerdem in „Erinnerung“ behält (immunologisches Gedächtnis).
Ob antigene Stoffe (z.B. Zelleiweiß) als fremd oder körpereigen erkannt werden, „lernt“ das Immunsystem etwa zum Zeitpunkt der Geburt. Die Stoffe, mit denen es zu dieser Zeit in Berührung kommt, erkennt es normalerweise lebenslang als körpereigen (immunologische Toleranz), alle später dazukommenden Stoffe als „fremd“. Versagt diese Unterscheidung von „fremd“ und „selbst“, kommt es zu Autoimmunerkrankungen, bei denen der Organismus Antikörper gegen körpereigene Proteine bildet.
Kommt z.B. ein Kind zum ersten Mal mit Masernviren in Berührung, erkrankt es an Masern, wobei das unspezifische System zwar voll wirksam ist, aber gewöhnlich nicht verhindern kann, dass sich die Viren im Körper vermehren und ausbreiten. Schon während der Erkrankung bildet der Organismus jedoch neben T-Killer-Zellen auch Antikörper gegen die Viren (Primärantwort oder Sensibilisierung), die damit unschädlich gemacht werden: die Masern heilen ab. Die Produktion der Antikörper kann bei Bedarf wieder rasch angekurbelt werden („Gedächtnis“!). Das wird dann ausgenützt, wenn später erneut Masernviren in den Organismus eindringen. Die diesmal schlag-artig einsetzende Antikörperproduktion (Sekundärantwort) macht die Viren gleich anfangs unschädlich, und eine erneute Masernerkrankung bleibt aus. Der Organismus ist immun dagegen.
Will man schon einer ersten Erkrankung vorbeugen, impft man mit einer harmlosen Abart des Erregers (z.B. Pocken), mit abgetöteten Erregern (z.B. Tetanus) oder mit synthetischen Teilen (Peptiden) davon, was, mehrmals durchgeführt, ebenfalls zur Antikörperbildung führt (aktive Immunisierung). Ist die Erkrankung bereits ausgebrochen, kann sie mit dem Serum oder dessen g-Globulin-Fraktion von Tieren bekämpft werden, die bereits Antikörper gegen den Erreger gebildet haben (passive Immunisierung, z.B. mit Diphtherieserum).
Unspezifische Abwehr
Der unspezifischen Abwehr von Fremdstoffen (Bakterien, Viren, anorganischen Partikeln usw.) und u.U. auch dem Abbau von körpereigenen Stoffen, z. B. von Erythrozytentrümmern u.ä., dienen bestimmte gelöste Stoffe wie Proteine (z.B. Lysozym, Komplementfaktoren), Signalstoffe (z. B. Lvmphokine und Monokine, zus. Interleukine genannt) und aggressive Verbindungen (z. B. O2-Radikale) sowie Phagozyten (Fresszellen), also Monozyten/Makrophagen und die neutrophilen Granulozyten. Letztere zählen zu den Leukozyten und werden im Knochenmark gebildet (Lebensdauer ca. 1 Tag). Die Granulozyten üben ihre Funktion nicht nur in Blut und Gewebe, sondern auch auf den Schleimhäuten des Körpers, z.B. im Mund, aus.
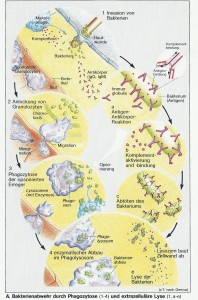
Dringen z.B. Bakterien in Körpergewebe ein (Abb. A 1), werden die neutrophilen Granulozyten durch chemische Fremdstoffe oder Komplementfaktoren (C 5a) angelockt (Chemotaxis, Abb. A 2). Granulozyten aus dem Blut heften sich dann an die Gefäßwand (Margination), verlassen die Blutbahn und bewegen sich auf den geschädigten Bezirk zu (Migration). Dort umschließen sie die Erreger und nehmen sie endozytotisch in sich auf: Phagozytose (Abb. A 3). Diese Vorgänge ergeben zusammen mit einer erhöhten Durchblutung (Rötung!) und einer vermehrten Kapillarpermeabilität für Proteine (Schwellung!) eine Entzündung.
Organische Stolle werden im Granulozyten „verdaut“. Dem geht ein Verschmelzen des phagozytierten Erregers (Phagosom) mit den enzymhaltigen Lysosomen des Granulozyten voraus. Im so entstandenen Phagolysom (Heterophagosom) wird der Erreger abgebaut (Abb. A 4). „Unverdauliche“ Partikel (z.B. Kohlenstaub in der Lunge) werden auf Dauer im Körper abgelagert.
Obwohl Mikroorganismen direkt an Phagozyten gebunden werden können, kann deren „Appetit“ wesentlich dadurch gesteigert werden, dass die Erregeroberfläche z.B. mit dem Komplementfaktor C3 b (unspezifisch), mit antigenspezifischen Immunglobulinen (lgM, IgG) oder, noch wirksamer, mit beiden „markiert“ wird (Opsonierung); die Phagozyten besitzen nämlich spezielle Rezeptoren für diese Opsonine. Die Voraussetzung für die Opsonierung mit Ig ist, dass der Organismus bereits früher mit dem Erreger Kontakt hatte (erworbene Immunität!), während C3 b und andere Opsonine an ein ganzes Spektrum von Erregern relativ unspezifisch binden.
Auch außerhalb der Phagozyten werden die Erreger (unspezifisch) attackiert. Die Reaktionskaskade des Komplementsystems endet mit der Perforation der Außenwand von (gramnegativen) Bakterien. Gleichzeitig baut Lysozym (in Plasma, Lymphe und Sekreten) die Wand der Bakterien enzymatisch ab, was schließlich zu deren Auflösung (Lyse) führt (Abb. A, a-e).
Zur Abtötung phagozytierter Erreger stehen den neutrophilen Granulozyten nicht nur die in den Lysosomen gespeicherten Enzyme, sondern auch Wasserstoffperoxid und andere oxidierende Sauerstoffradikale zur Verfügung. Normalerweise wird die Konzentration dieser Oxidantien durch reduzierende Enzyme wie Katalase und Superoxid-Dismutase auf niedrigem Niveau gehalten, um eine vorzeitige Eigenschädigung des Granulozyten zu verhindern. Diese „Zügelung“ wird bei der Invasion von Erregern aufgegeben, um die bakterizide (bakterientötende) Wirkung der Sauerstoffverbindungen voll zur Entfaltung kommen zu lassen, wobei auch die Granulozyten und, im Extremfall, sogar andere körpereigene Zellen in Mitleidenschaft gezogen werden.
Störungen des Phagozytosevorganges haben eine erhöhte Infektanfälligkeit zur Folge. Bekannt sind z.B. das „Syndrom der trägen Leukozyten“, bei dem die Migration gestört ist, oder die sog. chronische Granulomatose, bei deren Trägern die Wasserstoffperoxid-Bildung der Granulozyten defekt ist.
Die neutrophilen Granulozyten stehen zwar rasch und in großer Zahl am Infektionsort zur Verfügung, doch erlahmt ihre chemische Abwehrkraft schnell, und ihre Lebensdauer ist kurz. Nach der ersten „Angriffswelle“ der Granulozyten übernehmen die mobilen Makrophagen die weitere Abwehr. Sie stammen von den im Blut zirkulierenden Monozyten ab und sind ebenfalls zur Phagozytose befähigt. Die Wanderungsgeschwindigkeit der Makrophagen ist zwar geringer als die der Granulozyten, doch sind sie bedeutend langlebiger und außerdem zur länger dauernden Synthese von Enzymen, zur Sekretion von Komplement u.a.m. in der Lage.
Neben den zirkulierenden Monozyten/Makrophagen gibt es noch lokal wandernde Makrophagen, z.B. in der Leber (Kupfersche Sternzellen), in den Lungenalveolen, auf der Darmserosa, in den Milzsinus, in den Lymphknoten, in der Haut, in den Gelenkspalten (synoviale A-Zellen) und im Gehirn (Mikroglia), sowie endothelständige Makrophagen (z. B. in den Nierenglomeruli). Man nennt sie zusammen auch mononukleäres phagozytotisches System oder retikuloendotheliales System.
Auf die unspezifische Abwehr von Viren sind die natürlichen Killerzellen (NKZ) spezialisiert (= 5% der Blutleukozyten). Sie erkennen Änderungen an der Oberfläche virusinfizierter Zellen, lagern sich an diese an und töten sie ab, was den Viren nicht nur ihre Vermehrungsmöglichkeit (Enzymapparat der Zelle) entzieht, sondern sie auch für das übrige Abwehrsystem angreifbar macht. Aktiviert werden die NKZ durch Interferone, die meist von den virusbefallenen Zellen selbst gebildet und abgegeben werden. Interferone induzieren außerdem in den noch nicht infizierten Zellen eine erhöhte Virusresistenz.
Spezifische Abwehr
Die Phagozyten sind gegen eine ganze Reihe von Bakterien sehr wirksam, doch haben andere Erreger im Laufe der Evolution „gelernt“, sich gegen sie zu wehren. Bestimmte Erreger sind z.B. in der Lage, die Phagolysomenbildung zu unterdrücken (Mykobakterien), die Phagozytose überhaupt zu verhindern oder aber, einmal phagozytiert, den Granulozyten abzutöten (z.B. Streptokokken und Staphylokokken). Gegen solche Erreger und gegen die meisten Viren ist nur das spezifische Immunabwehrsystem wirksam, bei dem Makrophagen, humorale Antikörper (Immunglobuline) und verschiedene Typen von Lymphozyten eng „zusammenarbeiten“ (Kooperation; s.u.).
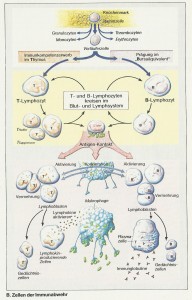
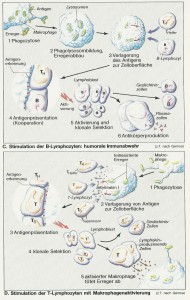
Die Lymphozyten stammen ursprünglich aus dem Knochenmark (Abb. B). Als sog. Vorläuferzellen wandern sie im Laufe der fetalen und frühkindlichen Entwicklung z.T. in den Thymus, wo sie ihre Spezifität (Immunkompetenz) erwerben: T-Lymphozyten. Ein anderer Teil der Lymphozyten wird bei Vögeln in der Bursa Fabricii, beim Menschen im „Bursaäquivalent“ (im Knochenmark; engl.: bone marrow) zu B-Lymphozyten geprägt. Später werden beide Lymphozytenarten vor allem in der Milz und in unterschiedlichen Bezirken der Lymphknoten gefunden. Von dort gelangen sie ins Lymph- und Blutgefäßsystem, kreisen dort und sind bereit, ihre Aufgaben bei der Immunabwehr wahrzunehmen. Ihre Lebensdauer kann Jahre betragen.
Ein erster Kontakt mit Antigen (antigenspezifische Rezeptoren an der Lymphozytenoberfläche!) hat bei beiden Lymphozytenarten eine Aktivierung zur Folge (s.u.). Sie werden dabei zu sog. Lymphoblasten umgeformt (Abb. B).
Humorale Immunabwehr (die auch zelluläre Komponenten hat; s.u.) wird eine spezifische Reaktion des Immunsystems genannt, bei der Immunglobuline (Antikörper) mit Antigenen, also mit Erregern, mit deren Toxinen oder mit anderen, körperfremden Makromolekülen (z.B. Fremdeiweiß), reagieren. Werden kleinmolekulare Stoffe (z. B. Medikamente) an körpereigene Proteine gebunden, können sie ebenfalls antigen wirksam werden. Solche Stoffe heißen Haptene.
Der Ausschüttung humoraler Antikörper gehen die Bindung des Antigens an membrangebundene Immunglobuline auf der B-Lymphozyten-Oberfläche (wirken hier als Rezeptoren) sowie die Präsentation des Antigens durch Makrophagen oder durch die B-Zelle selbst voraus.
Nach Phagozytose des Erregers durch Makrophagen (Abb. C 1) kommt es zur Phagolysombildung und zum Abbau des Erregers (Abb. C 2). Seine als Antigen wirksamen Bruchstücke werden in der Zelle an die dort ebenfalls lokalisierten Proteine des Haupt-Histokompatibilitäts-Komplexes (engl. major histocompatibility complex = MHC) der Klasse II gebunden. Der entstandene Antigen-MHC-Komplex wird in die Zellmembran des Makrophagen eingebaut (Abb. C 3) und den T-Helfer-(TH-)Lymphozyten präsentiert (Abb. C 4); sie besitzen für die beiden präsentierten Proteine gemeinsam spezifische Rezeptoren. Ganz ähnlich kann auch der B-Lymphozyt, der zuvor das (in diesem Fall lösliche) Antigen zusammen mit dem membranständigen Immunglobulin (Antigen-Rezeptor) internalisiert und bearbeitet hat, das (für B-Zellen und Makrophagen typische) MHC-Protein der Klasse II, an das das Antigen gebunden ist, präsentieren.
Auf diese B-Zell- oder Makrophagenvermittelte Doppelinformalion hin, d.h. bei Anwesenheit von (1) Antigen und (2) immunkompetenter Zelle, reagiert die TH-Zelle mit der Ausschüttung von Lymphokinen, die jetzt die B-Zelle aktivieren. Aktivierte B-Lymphozyten vermehren sich (klonale Selektion oder Expansion), wobei Gedächtniszellen und Plasmazellen entstehen. Sie sind darauf spezialisiert, das für das jeweilige Antigen spezifische Immunglobulin zu produzieren und exozytotisch ins Plasma abzugeben (Abb. B, C 5, 6). Diese Antikörperproduktion setzt bei einem wiederholten Kontakt mit dem Erreger sehr viel rascher und stärker ein, da die Information bei der Erstantwort in den Gedächtniszellen gespeichert wurde.
Die enorme Vielfalt der Antikörper (106-109?) ist nicht in den Keimzellen genetisch codiert, sondern bestimmte Genabschnitte (V, D, J, C) werden erst während der Lymphozytenentwicklung rekombiniert und mutiert.
Immunglobuline können Erreger nicht direkt vernichten, sondern markieren sie nur als Angriffsziel für andere Abwehrsysteme (Opsonierung, Komplementsystem, s.o.). In Serum und Gewebsflüssigkeit treten bei der Primärantwort zuerst IgM und später IgG in etwa gleicher Menge auf; bei der schnelleren Sekundärantwort herrscht die Abgabe von lgG vor. In Lunge, Tränenflüssigkeit, Speichel und Darm wird gegen eindringende Erreger vor allem IgA gebildet.
Der Säugling wird in den ersten Monaten gegen Krankheitserreger durch sein unspezifisches Abwehrsystem und durch humorale Antikörper geschützt, die er z.T. schon vor der Geburt über die Plazenta aus dem mütterlichen Plasma oder später mit der Muttermilch aufnimmt.
Gegen bestimmte Erreger (Viren, Mykobaklerien, Bruzellen u.a.) ist die humorale Immunabwehr nicht voll wirksam, da sie sich der intrazellulären Abtötung z.T. entziehen können. Diese Abwehrlücke schließt die sog. zelluläre Immunabwehr (Abb. D).
Eine ihrer Reaktionen, die von TH-Zellen ausgeübt wird, läuft relativ langsam ab (Maximum nach ca. 2 Tagen): sog. verzögerte Immunantwort. Die andere Reaktion, die der T-Killer-Zellen, ist für die Abtötung von virusinfizierten Zellen, von Tumorzellen und für die Abstoßung von transplantierten Organen, die von einem Organismus mit „fremden“ Histokompatibilitätsproteinen stammen, verantwortlich. An der zellulären Immunabwehr sind u.a. beteiligt: die TH-Zellen (s.o.), die die Immunantwort regulierenden T-Suppressor-(TS-)Zellen und die T-Killerzellen (s.u.) sowie antigenpräsentierende Makrophagen; eine Untergruppe davon, v.a. in Milz, Thymus und Haut, ist für diese Aufgabe besonders spezialisiert. Als interzelluläre Signalstoffe dieser Kooperation dienen schließlich die diversen, von den T-Zellen und Monozyten abgegebenen Lymphokine (spezielle Zytokine, z.B. Interleukine).
Die Startreaktion der zellulären Immunabwehr ist wieder die Phagozytose durch Makrophagen (Abb. D 1). Zwar lebt der Großteil der Erreger intrazellulär weiter, doch genügt für die Aktivierung der T-Zellen schon wenig Antigen, das zusammen mit MHC-Proteinen der Klasse II (für Aktivierung der TH-Zellen) bzw. der Klasse I (für Aktivierung der T-Killerzellen) an der Zelloberfläche den T-Zellen präsentiert wird (Abb. D 2). An der Aktivierung sind die Zytokine Interleukin 1 aus den Makrophagen und Interleukin 2 aus den TH-Zellen beteiligt (Abb. D 3). Solchermaßen aktivierte, für diese spezifische Abwehrreaktion „zuständige“ T-Zellen vermehren sich rasch (klonale Selektion, Abb. D 4), wobei neben Gedächtniszellen auch T-Zellen entstehen, deren diverse l.ymphokine (Interleukine u.a.) zur Aktivierung der Makrophagen führen. Diese sind jetzt in der Lage, mit fast allen Erregern und Fremdzellen fertigzuwerden.
Virusbefallene Körperzellen präsentieren also an ihrer Oberfläche Antigene des Virus zusammen mit MHC-Proteinen der Klasse I, die in allen kernhaItigen Körperzellen vorkommen. Für beide Proteine gemeinsam besitzen sog. zytotoxische T-Killer-(TC)Zellen Rezeptoren. Diese erkennen nur virusbefallene Zellen, d. h. es werden sinnvollerweise weder gesunde Zellen getötet, noch die Rezeptoren durch die Bindung freier Viren unwirksam gemacht. Die Bindung führt zur Abtötung der erkrankten Zellen (Folgen für die Viren: s.o. unter NKZ).
Trotz der genannten antiviralen Abwehrmechanismen gelingt es bestimmten Viren, jahrelang im Körper zu überleben (z. B. Hepatitis- und Herpesviren). Dieser Typ der „Slow-virus“-lnfektion ist noch relativ „konventionell“, was z.B. die Virusstruktur und die Immunantwort angeht. Die sog. „unkonventionellen Viren“, die Erreger der Scrapie-, Kuru- und Creutzfeld-Jakob-Erkrankung, lösen überhaupt keine Immunantwort aus und führen trotzdem zu langsam fortschreitenden Degenerationen im ZNS. Das humane Immundefizienz-Virus (HIV), der Erreger von AIDS, dezimiert die TH-(T4-)Zellen, die eine zentrale Rolle im Immunsystem spielen (s.o.). Dies hat zur Folge, dass das Leben von AIDS-Patienten durch zahlreiche, ansonsten harmlose Infektionserreger gefährdet ist.
Blutgruppen
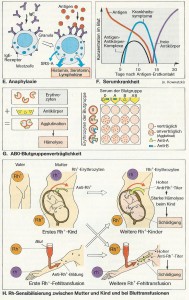
Auch die Erythrozyten besitzen antigene Eigenschaften, die sog. Blutgruppen. AB0-System: A (am Erythrozyt Antigen A, im Serum Antikörper Anti-B), B (B, Anti-A), 0 (weder A noch B, aber Anti-A + Anti-B), AB (A + B, weder Anti-A noch Anti-B) (Abb. G). Diese AB0-Antikörper gehören zur IgM-Klasse. Mit ihrem hohen Molekulargewicht von 900 000 überschreiten sie gewöhnlich nicht die Plazentaschranke.
Kommt z.B. bei einer Bluttransfusion fälschlicherweise A mit Anti-A oder B mit Anti-B in Berührung, verkleben die Erythrozyten (Agglutination; Abb. G) und platzen (Hämolyse). Vor einer Transfusion muss daher die Blutgruppe von Spender und Empfänger bekannt sein und die Blutverträglichkeit (Kreuzprobe) getestet werden.
Im Gegensatz zum AB0-System entstehen die Antikörper gegen die in C, D, E, c, e unterteilten Rhesuseigenschaften der Erythrozyten (vorhanden: Rh+, nicht vorhanden: rh–) nur nach vorheriger Sensibilisierung.
Die Rhesus-Antikörper sind plazentagängig, da sie zur IgG-Klasse gehören. Personen mit der Blutgruppe rh– können gegen Rh+-Erythrozyten Antikörper (Anti-Rh+) bilden (z.B. bei Fehltransfusionen oder Rh+-Kind bei rh–-Mutter). Ein späterer derartiger Blutkontakt führt zu starker Antigen-Antikörper-Reaktion, d. h. zu Agglutination und Hämolyse (Abb. H).
Allergie
Eine echte Allergie ist eine Regulationsstörung im Immunsystem. Es stuft z.B. ein harmloses Antigen (etwa Blütenpollen) fälschlich als „gefährlich“ ein, was zu einer Überreaktion führt. Bei allergischen Reaktionen gibt es den (anaphylaktischen) Soforttyp (s bis min) und den verzögerten Typ (Tage), die von der humoralen bzw. zellulären Immunabwehr vermittelt werden. Beim Soforttyp werden durch das Antigen (= Allergen) B-Zellen sensibilisiert, deren Plasmazellen beim Zweitkontakt rasch sehr viel IgE ausschütten (normal beträgt IgE nur 0,001% der Ig). Eine Bindung des Allergens an 2 IgE, die ihrerseits an IgE-Rezeptoren der Mastzellen gebunden sind (Abb. E), führt dort zur Exozytose der Granula, womit Histamin, Serotonin, Lymphokine u.a.m. ausgeschüttet werden. Sie wirken v.a. auf Gefäße (Dilatation, Ödeme!), Schleimdrüsen (Heuschnupfen!) und sensorische Nervenendigungen (Jucken!). Auch die Synthese und Abgabe von Prostaglandinen und Leukotrienen wird stimuliert. Letztere sind z. B. Komponenten von SRS-A (slow reacting substance of anaphylaxis); SRS-A wirkt stark bronchokonstriktorisch (Asthma!).
Den verzögerten Typ der Allergie können Mykobakterien (z.B. Tbc), Pilze, sog. Kontaktallergene (z. B. Chrom) u.a.m. auslösen. Eine Allergie im weiteren Sinn ist die Serumkrankheit (Abb. F), eine Folge sehr hoher Antigenzufuhr, z.B. bei passiver Immunisierung.